文章图片
文章图片
文章图片
来源:【高分子材料科学】微信公众号
【前言背景】
利用药物治疗癌症的抗癌疗法确实抑制了肿瘤的发展 , 甚至在一定程度上抑制了转移 , 从而提高了癌症患者的生存率 。 然而 , 由于不受控制的组织分布和治疗剂的始终有效的药物作用 , 低疗效和不良副作用仍然是临床上癌症治疗的主要挑战 。 外部刺激(例如 , 热能 , 光 , 磁场和超声波)可以很好地控制治疗药物的激活过程 。 其中 , 光具有无创性 , 操作简单 , 适应性强 , 时空均可控的优点 。 作为从半导体聚合物(SP)转变而来的有机光学纳米材料 , 半导体聚合物纳米材料(SPN)在生物医学领域引起了很多关注 。 SPN具有良好的生物相容性和尺寸无关的光学性能 , 这使其与大多数半导体无机纳米颗粒区别开来 。 此外 , 它们通常具有出色的光稳定性 , 可以通过简单的分子工程设计为显示可调的光学性质 。
【研究成果】
日前 , 新加坡南洋理工大学浦侃裔教授团队总结了SPN作为可用于癌症治疗的近红外(NIR)光活化治疗剂 。 SPN由π共轭聚合物转化而成 , 该聚合物可将NIR光有效地转化为热量或单线态氧(1O2) 。 具有光热和光动力特性的SPN可以直接用作光医学或用作光传感器 , 以激活热量或对1O2敏感的治疗药物 。 通过将SPN与治疗剂(例如激动剂 , 基因和酶)负载或缀合来开发可热激活的基于SPN的治疗剂 。 例如 , 光热触发的激动剂释放会特异性激活细胞膜上的某些蛋白质离子通道 , 从而导致离子过量流入引起线粒体功能障碍 , 进而导致癌细胞凋亡 。 而且 , 对温度敏感的菠萝蛋白酶的光热活化可以促进胶原蛋白的原位降解(细胞外基质的主要成分) , 从而导致改善的试剂在肿瘤组织中的积累 , 扩大治疗效果 。 全文‘‘Semiconducting Polymer Nanomaterials as Near-Infrared Photoactivatable Protherapeutics for Cancer’’发表在美国化学会《Accounts of Chemical Research》上 。 该报告强调了SPN在构建多功能NIR光活化性治疗剂方面的潜力 , 该治疗剂可在指定的时间和位置以较高的治疗结果和精准治疗癌症 。
【图文解析】
1. 制备和光转化
SP是具有π电子离域主链的有机聚合物 , 并具有良好的光学性质 。 如poly(silolodithiophene-alt-diketopyrrolopyrrole)(SP1 , ~26 000 Da)被设计成具有吡咯并吡咯二酮和硅的结构单元 , 缩小的带隙和红移吸收 。 聚(cyclopentadithiophene- ALT -benzothiadiazole)(SP2)含有环戊二烯单元如在骨架中的供体 , 呈现出相对窄的能带隙 , 以确保强NIR吸收 。 水溶性SPN通常是通过疏水性SP和两亲共聚物的纳米沉淀制备的(图1a) 。 除了赋予SPN良好的水溶性外 , 两亲性聚合物还提供了化学反应基团 , 可通过靶向配体(例如肽和抗体)和小分子抑制剂对SPN进行后修饰 , 从而实现细胞部位(例如膜受体和细胞器)的特异性靶向)和细胞内信号通路的调节 。 在此制备过程中 , 可以将疏水性成分(例如 , 感应分子 , 电子受体 , 抗癌药和无机纳米粒子)封装到SPN中 , 以实现多功能化 。
图1.用于光活化治疗剂的SPN的制备 。
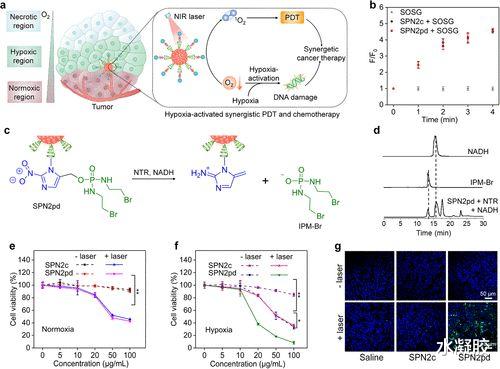
自组装是另一种方法合成的SPN(图1b) 。 带有叠氮侧基的疏水性SPs通过反应性接头(例如 , 低氧可裂解和1O2可裂解的接头)与治疗剂偶联的PEG链接枝 , 形成两亲性SP , 它们可溶于水溶液并可以组装成水可溶性SPN 。 或者 , 将大分子治疗剂(例如酶)后缀合到所制备的纳米颗粒的表面上是可行的 。 这种自组装的SPN通常具有更小的尺寸(18-30 nm)和较高的表面接枝PEG密度(?0.9 PEG /nm2)不是通过纳米沉淀合成的(30-50 nm , ?0.2 PEG /nm2) , 因此通常在静脉注射后通过增强的通透性和保留(EPR)效应具有更好的肿瘤蓄积性 。
2. 光热激活的治疗药物
2.1 半导体聚合物纳米激动剂
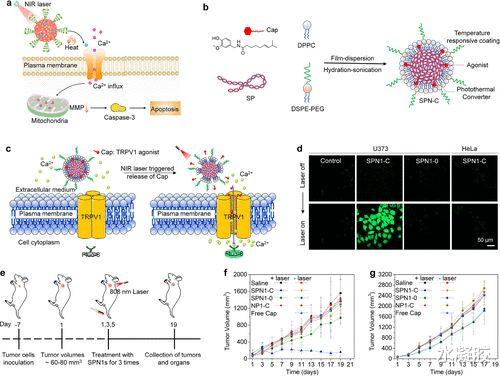
辣椒素(Cap)是一种激动剂 , 可以特异性激活瞬时受体电位阳离子通道亚家族V成员1(TRPV1) , 这是一种在神经元细胞和某些类型的癌细胞膜上过表达的典型Ca2+阳离子通道蛋白 。 由于化学毒性或诱导Ca2+过度流入的能力 , 它可以用于治疗癌症 。 但是 , 由于药物的非特异性药理学特征 , 它们对健康细胞的潜在毒性经常发生 。 最近开发的光热活化的半导体聚合物nanoagonist(SPN1-C) , 用于经由激动剂的远程控制释放特定癌症治疗(图2a) 。 SPN1-C是自组装纳米沉淀通过从SP1 , Cap , DSPE-PEG , 和DPPC(图2b) 。 众所周知DPPC在41°C的相变温度 , DPPC和DSPE-PEG被用作纳米颗粒的温度响应涂层 。 在SPN1-C中 , 随着温度的升高 , 货物逐渐释放 , 由于脂质层的熔化 , 在41至44°C之间急剧释放 。
推荐阅读
- 癌症会传染吗?人类接触癌细胞不会传染!但要小心这3种病毒 。
- 发现难、治愈难,人类什么时候才能攻克癌症?
- 研究表明,地球上的第一个生命依赖于一种致命的有毒气体
- 首例“猴子换头”实验在我国完成,总花费7000万,猴子的现状如何?
- 心脏为何会成为癌细胞禁地?原来它根本不给癌细胞任何机会.
- 探索核聚变原理,核聚变反应堆一定会越来越小,美国又走在了前面
- 龙虾的秘密:美洲龙虾越捕越多?龙虾如何把原来的天敌,变成猎物
- 这位美国科学家,给100多人注射癌细胞,为了求证癌症是否传染
- 打碎癌细胞的DNA,日立粒子线系统治疗癌症就这么精准
- Cell:无论抗癌,还是抗感染,强大的免疫系统需要“镁”力!